Matériel
– Une barrette de 8 puits ou plaque de microtitration (gardé d’un ancien TP kit Elisa)
– Une solution mère d’anticorps anti-antigène, 1 mL (C1) solution d’empois amidon à 100g/l et sulfate de cuivre 4%
– du sérum témoin (non immunisé) (T) eau distillée
– Du sérum à tester(X) fait à partir de C1
– Une solution d’anticorps conjugués de détection(AC) eau distillée
– Une solution de lavage tween (lav) eau distillée
– Une solution de tampon PBS (tp) eau distillée
– Une solution de substrat de l’enzyme peroxydase, le TMB(TMB) soude 4%
– Une micropipette et des cônes
– Des tubes
– Papier essuie-tout
Pour la préparation de la solution mère d’anticorps anti-antigène, il s agit d’une solution d’empois amidon à 100g/l et sulfate de cuivre 4%. Ce ne sont pas 2 solutions à part mais une seule : on fait la solution d’empois dans la solution de sulfate de cuivre. Il faut préparer d’abord la solution de sulfate de cuivre, la faire chauffer, à la première ébullition ajouter le lait d’amidon (amidon mélangé avec un peu d’eau : cela évite ensuite les grumeaux dans la solution) et laisser bouillir quelques minutes puis laisser refroidir : nous obtenons une solution épaisse bleutée.
Pour la préparation du sérum témoin (non immunisé) (T), il s’agit simplement d’eau distillée : il faut ajouter du colorant alimentaire pour avoir la même couleur que la solution mère d’anticorps anti-antigène.
La solution d’empois d’amidon est épaisse , elle reste ainsi au fond du puits et ne tombe pas lors des différents lavages (si on reste délicat). Le sulfate de cuivre permet avec la soude d’avoir une réaction colorée.
Protocole
– Réaliser la gamme étalon: à partir de 1mL de la solution d’anticorps anti-antigène (C1), réaliser une dilution en cascade d’un facteur ½ à chaque étape, c’est à dire prélever 0,5 mL de la solution d’anticorps anti-antigène et compléter avec 0,5 mL de tampon PBS (tp), dans des tubes, de C2 à C6.
– Repérer les puits et déposer dans 80 µL du sérum à tester, du sérum témoin et des anticorps anti-antigène à différentes concentrations, en prélevant avec la même micropipette des concentrations les plus faibles vers les concentrations les plus fortes.
– Laisser incuber 2 minutes à température ambiante. Il est évident qu’attendre ne sert à rien mais on voulait garder la même méthode que dans le vrai tp elisa sauf que l’on a reduit à 2 min au lieu des 15 min.
– Pour vider la barrette, la retourner très délicatement (sans taper) sur du papier essuie-tout pour éliminer l’excès de produits et éviter la contamination. Geste rapide !!! mais tout en délicatesse sinon tout les produits se vident des puits.
– Laver les puits :
Remplir tous les puits avec la solution de lavage(jusqu’à obtention d’une goutte en surface) et vider comme précédemment.
– Mettre dans tous les puits 40 µL de la solution d’anticorps conjugués de détection
Attention les élèves ont tendance à faire tremper les cônes dans les solutions d’où contamination
Laisser incuber 2 minutes.
Vider les puits et les laver.
Mettre dans les puits 80 µL de substrat de l’enzyme peroxydase, le TMB.
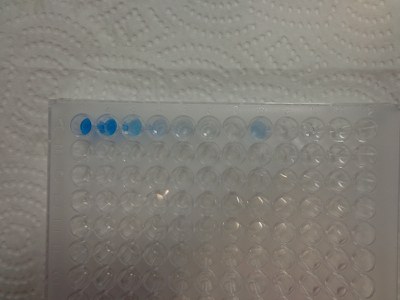
Observer les colorations. Résultats obtenus au laboratoire :
Résultats d’élèves
avec 2 sujets à tester différents (on donne aux élèves un sujet à tester mais il est soit négatif soit positif mais avec une concentration différente) :
Document et photos réalisés par Mme Degardin-Wiart Isabelle (ATRF P Cl 1, Lycée Paul Duez, Cambrai)